Epigenética: Cuando los caracteres aquiridos se heredan
Hace unas tres décadas sabíamos que la mitad de nuestro ADN lo heredábamos de nuestro padre y la otra mitad de nuestra madre. En esa época se creía que la transferencia de ADN del espermatozoide o del óvulo al embrión era la única forma con la que los progenitores transmitían información hereditaria a la descendencia, al menos en los humanos y otros mamíferos.
Si bien es cierto que muchas de las características del niño o la niña están escritas en su ADN (en concreto, en los genes que codifican la forma y la función de las proteínas), hoy sabemos que la experiencia diaria también importa. Muchos de los avatares de la vida, como la alimentación, los contaminantes y el estrés, afectan al funcionamiento de los genes. Así, pues, se recurre a factores sociales o ambientales para explicar por qué dos gemelos idénticos terminan padeciendo enfermedades distintas a pesar de poseer dotaciones genéticas muy similares.
Por aquella época ignorábamos que el legado biológico que cedemos a nuestros hijos incluye algo más que nuestras secuencias de ADN. De hecho, no solo nuestros hijos, sino también nuestros nietos y bisnietos, podrían heredar lo que se conoce como “información epigenética”.
Esta, al igual que el ADN, reside en los cromosomas (que albergan los genes) y regula funciones de la célula. Pero es distinta de la secuencia de ADN y responde a los cambios ambientales. Puede adoptar formas diversas, entre ellas pequeñas moléculas que se unen químicamente al ADN y a las proteínas que se hallan presentes en los cromosomas.
La epigenética es un compendio de mecanismos celulares que permiten explicar por qué somos como somos, o por ejemplo, por qué gemelos univitelinos (genéticamente idénticos) pueden presentar un desarrollo completamente distinto y una predisposición a patologías como el cáncer o el Alzheimer. También ayuda a entender por qué, a pesar de tener el mismo genoma, una célula neuronal es así y es distinta de una del corazón o de la piel.
El término fue propuesto en 1939 por Conrad Hal Wadington y lo hizo para referirse a ¡¡todos aquellos mecanismos no genéticos (no explicables debido a la secuencia de nuestro ADN) que alteran la expresión génica y que por ende definen el fenotipo del organismo!!
Hoy en día la epigenética es uno de los campos científicos más interesantes y con mayor recorrido, sobre todo en neurociencias. Científicos de todo el mundo estudian cómo los factores ambientales (refiriéndonos no sólo a nuestro medio ambiente, sino también al "ambiente" de nuestras células) son el origen de patologías tales como el cáncer o enfermedades neurodegenerativas como el Alzheimer.
¿Y cuáles son estos cambios y cómo se producen?
La “epigénesis”, como hemos dicho ya antes, es un proceso celular normal que regula la expresión génica, por lo tanto regula qué proteínas dispone la célula en cada momento. Esta regulación puede ser a corto o largo plazo y para ello existen 3 grandes "marcas" epigenéticas:
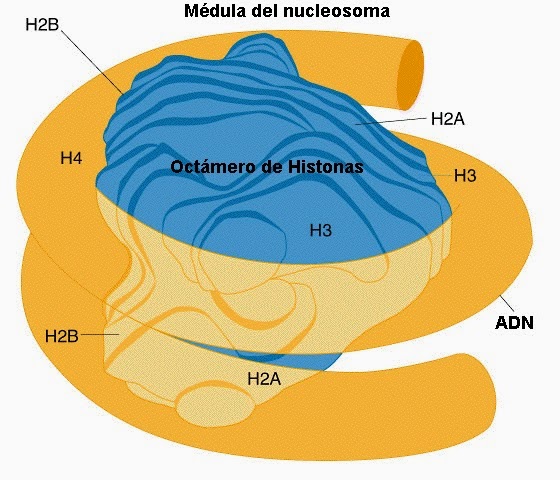
Modificaciones de las “histonas”. El ADN se encuentra en el núcleo celular “altamente empaquetado”, formando una estructura llamada “cromatina”. La unidad funcional de la cromatina es el “nucleosoma”, que está compuesto por un núcleo proteico llamado el “octámero de histonas” (2 copias de los cuatro tipos de proteínas H2A, H2B, H3 y H4) y el ADN enrollado a su alrededor.
La “epigénesis”, como hemos dicho ya antes, es un proceso celular normal que regula la expresión génica, por lo tanto regula qué proteínas dispone la célula en cada momento. Esta regulación puede ser a corto o largo plazo y para ello existen 3 grandes "marcas" epigenéticas:
- Modificaciones de las histonas
- Modificaciones del ADN
- ARN no mensajero y “no codificante”.
Modificaciones de las “histonas”. El ADN se encuentra en el núcleo celular “altamente empaquetado”, formando una estructura llamada “cromatina”. La unidad funcional de la cromatina es el “nucleosoma”, que está compuesto por un núcleo proteico llamado el “octámero de histonas” (2 copias de los cuatro tipos de proteínas H2A, H2B, H3 y H4) y el ADN enrollado a su alrededor.
Las “histonas” son proteínas que se encargan de empaquetar el ADN formando una especie de “ovillo” sobre el que se enrolla la cadena de ADN. Su finalidad es múltiple, sirve de mecanismo de empaquetado, de mecanismo protector y de mecanismo regulador. La modificación de estas proteínas “histonas” es uno de los procesos epigenéticos más importantes y dinámicos de que disponen las células de nuestro organismo. Actualmente conocemos diversas modificaciones de las “histonas” pero de éstas, 4 tipos han sido las más estudiadas: acetilación, metilación, ubiquitinación y fosforilación. La complejidad de estas “alteraciones de las histonas” se multiplica exponencialmente ya que dichas modificaciones pueden ocurrir de manera simultánea en la misma proteína. Por ello se formuló la hipótesis del "código de histonas", el cual representaría un conjunto de alteraciones de estas proteínas cuyo resultado final sería la regulación de la expresión de un determinado gen.
La complejidad de la estructura y función de nuestro genoma puede ilustrarse mediante el siguiente ejemplo: en los seres humanos, el ADN de cada una de nuestras células se organiza en un “cariotipo” formado por 23 pares de cromosomas que contienen aproximadamente 25.000 genes. En total, la molécula de ADN completa de una sola célula mide alrededor de 2 metros de longitud. Intentemos ahora hacer el siguiente cálculo: si en nuestro cuerpo existen (como promedio) alrededor de 50 mil millones de células y cada una posee 2 metros de longitud, ¿cuál es la longitud total del ADN existente en todas nuestras células? La respuesta es asombrosa: 100.000 millones de kilómetros, o lo que es lo mismo, la longitud conjunta del d ADN de todas las células del cuerpo humano equivale a 8.6 veces el diámetro del sistema solar (11,580 millones de kilómetros).
El material hereditario debe empaquetarse en un compartimento conocido como “núcleo celular”, el cual posee un diámetro de entre 6 y 10 micrómetros (1 metro = 1.000.000 de micrómetros), es decir 200.000 veces menor que la longitud de nuestro ADN extendido. ¿Cómo es posible?
La solución arquitectónica seleccionada por el proceso evolutivo consiste en ¡¡enrollar la molécula de a ADN alrededor de unas proteínas!!, del mismo modo que enrollaríamos el sedal en el carrete de una caña de pescar. La asociación entre el ADN y estas proteínas (conocidas como “histonas”) constituye un polímero al que denominamos “cromatina”. “Histonas y cromatina” juegan así un papel primordial no sólo en el empaquetamiento del ADN en las células, sino también en su correcta función en el interior de las mismas. El origen evolutivo de estas proteínas se remonta más de 2,000 millones de años en el pasado, permitiendo acomodar un genoma cada vez más grande en el interior de la célula (y facilitando así el incremento en la complejidad de los seres vivos).
El
ADN se empaqueta en el interior del núcleo celular enrollándose sobre
un soporte proteico formado por diferentes tipos de histonas, dando
lugar a un polímero denominado “cromatina”. La subunidad fundamental de
este polímero es el “nucleosoma”, alrededor del cual se enrollan
aproximadamente 147 nucleótidos de ADN . De este modo, la cromatina es
una sucesión de nucleosomas. En el margen inferior izquierdo de la
figura se muestra la estructura molecular del nucleosoma en visión
dorsal (1) y frontal (2).
La organización del ADN en la cromatina constituye una solución para el empaquetamiento de material hereditario en la célula. Sin embargo, plantea un nuevo problema similar al que tendríamos al organizar una gran cantidad de libros en las estanterías de una biblioteca: cada vez será más difícil localizar el libro que nos interesa leer. Similarmente, el incremento en el grado de empaquetamiento del genoma hace que cada vez sea más complicado acceder a genes concretos en un momento determinado.
La “cromatina” proporciona una solución a este problema, ya que ¡constituye un sistema de catalogación de los genes contenidos en nuestro genoma! Lejos de ser una estructura uniforme, la cromatina consta de diferentes regiones con diseños heterogéneos, desde más compactos (heterocromatina) hasta más laxos (eucromatina). Si bien existía constancia previa de dicha heterogeneidad, no fue hasta mediados los años 90 cuando los estudios pioneros de David Allis demostraron que las “histonas” intervienen en el “empaquetamiento” y “desempaquetamiento” selectivo de diferentes regiones del genoma en respuesta a señales celulares específicas.
Proceso de “empaquetamiento del ADN”
Hoy sabemos que la modificación en el “empaquetamiento de la cromatina” posee implicaciones para la función del ADN y que ésta viene determinada por las histonas. Sus modificaciones químicas, la posición relativa de estas modificaciones en las histonas (histone crosstalk) y la interacción con complejos moleculares remodeladores de la cromatina. Algunos autores se han atrevido incluso a hipotetizar que la acción combinada de estos mecanismos constituye un lenguaje, el "código de las histonas".
Adicionalmente, estudios recientes sugieren que el ARN juega también un papel regulador importante, dado que podría determinar diferentes niveles de compactación en la “cromatina”. De este modo, podemos concebir la “cromatina” como un “polímero dinámico” que cataloga nuestro genoma, capaz de transmitir señales a nuestro ADN que determinarán qué genes deben ser expresados en respuesta a las condiciones ambientales externas.
La
“cromatina” es capaz de transmitir señales externas a la molécula de
ADN, determinando qué genes serán activados y cuales reprimidos. Estas
señales no implican cambios en la secuencia del ADN y pueden prevalecer
en la célula, como una memoria, de generación en generación. De este
modo, dos células genéticamente idénticas pueden responder de modo
distinto a condiciones ambientales diferentes y esta respuesta puede ser
"heredada" por sus células hijas como “información epigenética” (dado
que todas ellas poseen exactamente la misma información genética).
La “acetilación de las histonas” es de lejos el proceso más estudiado. La acetilación añade grupos acetilo (COCH3) al aminoácido “lisina” en el extremo N- de las histonas H3 y H4. La reacción es catalizada por las “histona acetiltransferasas (HAT)”. La “acetilación” elimina la carga positiva de la cadena lateral de la “lisina”, eliminando la unión de la lisina al ADN, que causa una unión disminuida o aflojada de histona:
La “acetilación de histonas” está asociada, grosso modo, con la “activación génica” y esta es clave para el normal “desarrollo del aprendizaje”. Parece evidente que los “distintos procesos de aprendizaje” expresan “patrones específicos de acetilación de histonas”, pero que la acetilación de la histona H3 y H4 son las más comunes en estos procesos de plasticidad neuronal.
Al igual que la acetilación, la “fosforilación de histonas” ha sido caracterizada, aunque en menor medida, como participante en la “activación génica”, siendo la histona H3 la que más frecuentemente presenta dicha modificación.
La “metilación de histonas” también ha sido relacionada con procesos de aprendizaje y memoria aunque desconocemos mucho de su función dada su complejidad. La metilación puede darse en argininas o lisinas y en tres formas distingas (mono-, di- y trimetiladas). La combinación de todas estas posibilidades puede tener como resultado final tanto la “activación” como la “inhibición” de la “expresión génica”.
La “metilación” (añadir un grupo metilo) sucede tanto en las “proteinas histonas” como “en el ADN”. Ambas moléculas son capaces de recibir esta modificación. Estos procesos no pueden provocar mutaciones. “EPI” significa por encima. El nombre de “epigenética” viene de eso, son procesos ajenos a la modificación de la secuencia. No alteran el código, pero sí la manera de leerlo.
Los mecanismos epigenéticos regulan la “transcripción génica”, tanto a corto como a largo plazo. Para ello, utilizan como ya hemos dicho diversos mecanismos moleculares como la modificación de histonas, la metilación del ADN o los ARN no codificantes.
La “metilación de citosinas” en el ADN es un mecanismo epigenético muy estudiado y generalmente se traduce en una ¡represión de la expresión génica!
La secuencia de nuestro ADN está compuesta por la concatenación de 4 nucleótidos. Éstos están formados por un “azúcar” (la desoxirribosa), una “base nitrogenada” (que puede ser adenina, A, timina, T, citosina, C, o guanina, G) y un “grupo fosfato” que actúa como enganche al siguiente nucleótido. Las distintas combinaciones de nucleótidos de adenina, timina, citosina y guanina conforman el código genético de nuestras células. Dicho código genético es transcrito a “ARN mensajero”, que a su vez será traducido a proteínas. La “metilación del ADN” lo que hace es bloquear, generalmente, que la secuencia sea leída y transformada en proteínas, ejecutoras de la función celular.
La
metilación del ADN se produce por la adición de un grupo metilo (-CH3) al quinto átomo de carbono del anillo
de citosina (con 6 átomos de carbono), creando la 5-metilcitosina (5mC).
Esta modificación se lleva a cabo por un conjunto de enzimas llamadas “ADN metiltransferasas”. Estas proteínas, detectan “grupos de citosinas seguidas inmediatamente de guaninas (CpG)” y las metilan. Las “secuencias CpG” están poco representadas en el genoma y cerca del 70 % de ellas se encuentran metiladas. El 30 % restante forma las llamadas “islas CpG” que se encuentran principalmente en las secuencias que regulan la activación de los genes o en secuencias dentro de los genes (intragénicas).
Como ya hemos comentado, normalmente la metilación del ADN se traduce en un bloqueo de la expresión del gen afectado. Pero los mecanismos asociados a la regulación génica siempre son dependientes de contexto. Por ello, “la represión” sucede cuando se metilan “secuencias promotoras” (las que regulan el inicio de la transcripción). No obstante, si la metilación sucede en secuencias localizadas ya “en el interior de los genes” (intragénicas), normalmente lo que encontramos es un efecto contrario, es decir, un “incremento de la expresión” de dicho gen.
En los últimos años cada vez hay más pruebas que indican que las modificaciones epigenéticas pueden persistir durante varias generaciones en una amplia gama de especies: entre ellas plantas, moscas, gusanos, peces, roedores y cerdos.
En 2012 se publicaron los efectos observados en ratas gestantes a la exposición a la “dioxina” (combustible de aviones); a repelentes de insectos o a una combinación de “bisfenol A” y “ftalatos” (componentes que se utilizan para recubrir envases alimentarios de plástico y en los empastes dentales). Estas sustancias provocan una serie de trastornos hereditarios en los descendientes de cuarta generación, como anomalías en la pubertad, obesidad y enfermedades en los ovarios, los riñones o la próstata.
Se han hallado cientos de alteraciones en la “metilación del ADN” en los espermatozoides relacionados con dicha exposición.
En la actualidad se están llevando a cabo estudios para determinar si las “modificaciones epigenéticas” afectan, también, a varias generaciones, como ocurre en otros animales. Así, la fumigación con el insecticida DDT (prohibido hace bastante tiempo, pero habitual durante las décadas de los años cuarenta y cincuenta del siglo XX para controlar la población de mosquitos), podría haber causado “modificaciones epigenéticas” que persisten en algunos niños que nacen hoy:
Fumigación con DDT
La metilación del ADN ha centrado la atención de los científicos por su participación en diversos procesos fisiológicos y patológicos. Se ha descrito que la metilación del ADN también participa en proceso de aprendizaje y memoria. Pero es en los “procesos patológicos” donde se ha avanzado más en el conocimiento de la función del “ADN metilado”. El cáncer es el proceso patológico asociado a alteraciones epigenéticas mejor caracterizado y la “metilación del ADN” fue la primera marca epigenética asociada a dicha enfermedad.
Los procesos de metilación del ADN han sido también relacionados con procesos neurodegenerativos como el alzhéimer y otras enfermedades neurodegenerativas. Otras enfermedades neurológicas han sido asociadas a alteraciones de estas proteínas. Por ejemplo, la depresión, el autismo.
Hoy en día nadie duda que el proceso de metilación del ADN es un proceso dinámico. Además de la metilación de citosinas, también existe la “hidroximetilación” (5hmC). Este proceso, reconoce citosinas metiladas y las oxida.
Esta modificación tiene un efecto contrario a la 5mC puesto que “activa la expresión génica”. De hecho, la oxidación de la 5mC podría ser un estadío intermedio puesto que las 5hmC acaban perdiendo el grupo metilo.
La hidroximetilación del ADN recibió un gran impulso en 2009 cuando un grupo de investigación redescubrió la presencia de 5hmC, y además su existencia en el cerebro. De hecho, el sistema nervioso central se encuentra enriquecido de 5hmC respecto a otros órganos y actualmente se considera una de las marcas epigenéticas más importantes en el desarrollo cerebral y en los procesos patológicos asociados a, por ejemplo, enfermedades neurodegenerativas.
En 2011 se publicó un estudio que explicaba el mecanismo mediante el cual la temperatura influye en la determinación del sexo de un animal. La definición de este rasgo en los mamíferos se basa en la genética cromosómica. Sin embargo, en otros vertebrados, como reptiles o peces, la determinación del sexo puede ser no solo genética sino también “ambiental”.
En la determinación “ambiental”, los valores de un factor externo durante el desarrollo temprano definen el sexo de los individuos. El factor mejor conocido corresponde a la temperatura, que controla el “fenotipo” de algunos peces y de numerosos reptiles, entre ellos ciertos lagartos, muchas tortugas terrestres, las tortugas acuáticas y los cocodrilos. En los estudios realizados se ha puesto de manifiesto los mecanismos epigenéticos en la determinación del sexo. De manera que se ha observado en estudios realizados con “lubinas” que temperaturas superiores a los 17º C tienen efectos masculinizantes. En cambio, en la “tortuga escurridiza” durante la fase de incubación se generan machos si la temperatura ronda los 26º C, mientras que a 31º C se engendran hembras.
En ambos casos las “temperaturas masculinizantes” implican una mayor “metilación” del ADN en el gen que codifica la enzima “aromatasa”, que cataliza la síntesis de “estrógenos”, que a su vez resultan imprescindibles para el desarrollo del ovario. Como resultado de dicha “metilación” el proceso queda inhibido.
Lubinas
La interacción entre la información presente en el material hereditario (genética) y la determinada por las modificaciones de la cromatina (epigenética) constituye un nivel de complejidad superior y muy poco conocido en la regulación del DNA.
Si bien no existe duda acerca del valor epigenético de las histonas, sí se plantean en la actualidad muchos interrogantes acerca de cuál es su papel específico en este proceso. Por ejemplo, ¿cómo se transmite la información epigenética al nuevo DNA tras la división celular?, ¿es posible que dicha información se perpetúe únicamente mediante las histonas?, ¿existen otros factores capaces de determinar modificaciones epigenéticas en la cromatina?
Tal y como mencionamos anteriormente, una de las hipótesis que más expectación ha suscitado sugiere que estos factores son pequeños “fragmentos de RNA no codificantes”. Esta explicación está respaldada por estudios que demuestran que la mayor parte del genoma se transcribe de DNA a RNA (esta transcripción sería únicamente necesaria en el caso de regiones de DNA con genes codificantes de información genética, los cuales constituyen sólo entre un 1.5% y un 2% del total de nuestro DNA).
¿Por qué se transcribe entonces todo este RNA sin información aparente?). Parece que la respuesta tiene que ver con su papel en la “regulación de la información epigenética” ya que, al menos en el caso de levaduras, estos pequeños segmentos de RNA pueden activar mecanismos capaces de modificar la estructura de la “cromatina” de una manera extremadamente precisa.
Desde el punto de vista evolutivo, la epigenética (aunque parezca irónico) podría ser definida como el estudio de la herencia de los caracteres adquiridos. Muchos investigadores han descrito incluso la herencia de los caracteres epigenéticos como Neo-Lamarckista. Tal y como reseñamos previamente, Jean-Baptiste Lamarck fue el primero en desafiar el concepto creacionista y el fijismo de las especies ya en el siglo XIX, proponiendo que los caracteres adquiridos por un individuo serían heredados por su descendencia. La comprobación científica de las hipótesis propuestas por Charles Darwin y Alfred Russell Wallace (lo cual las eleva a la categoría de Teoría) demostraron que la interpretación de Lamarck era errónea. Sin embargo, el estudio del material genético (al que tanto Lamarck como Darwin eran ajenos) en los albores del siglo XXI sugiere que muchos rasgos adquiridos son heredados de una generación a la siguiente.
Por tanto, la gran pregunta es la siguiente: ¿es posible reconciliar la epigenética con la Teoría de la Evolución propuesta por Darwin? Parece que el consenso en la comunidad científica apunta a una respuesta afirmativa.
Si el ambiente puede provocar cambios transgeneracionales a largo plazo en la actividad génica sin alterar la “secuencia codificante del ADN”, entonces habrá que ampliar el “concepto clásico de evolución” (el lento proceso de mutaciones aleatorias que son “seleccionadas” porque favorecen la reproducción o la supervivencia).
Incluso puede que la “herencia epigenética” llegue a explicar por qué surgen nuevas especies con más frecuencia de lo que cabría esperar, teniendo en cuenta lo improbable que resultan las mutaciones genéticas ventajosas. Los “cambios epigenéticos” parecen producirse con una frecuencia mil veces mayor.
El efecto más importante de las “marcas epigenéticas”, podría ser el de aumentar tremendamente el número de variantes individuales en una población. Más tarde, la “selección natural” se encargaría de elegir los mejor adaptados entre ellos para que proliferen y se perpetúen, junto con su genoma y su epigenoma.
Fuentes:
- “Epigenética: Caracteres adquiridos sobre nuestros genes” de José Mª Eirin-López;
- “¿Qué es epigenética?¿Y tú me loo preguntas? Epigenética … eres tú.” de Raul Delgado;
- “Epigenética, temperatura y sexo” de Francesc Piferrer;
- “Un nuevo tipo de herencia” de Michael K. Skinner.
- ramanujan25449: http://ramanujan25449.blogspot.com/2015/03/cuando-los-caracteres-adquiridos-se.html.
---
14 de marzo de 2015
14 de marzo de 2015























0 comments: